In de klinische praktijk wordt vaak vertrouwd op nuchtere glucosewaarden en HbA1c om de bloedsuikerbalans te beoordelen. Maar steeds vaker blijkt dat deze parameters een belangrijk deel van het verhaal niet vertellen, namelijk de dagelijkse pieken en dalen. Time-in-Range (TIR), een relatief nieuwe maat op basis van continue glucosemonitoring (CGM), biedt een gedetailleerder inzicht in de kwaliteit van de bloedglucoseregulatie. Dit maakt TIR relevant bij preventie, vroegtijdige interventie en het begeleiden van cliënten met prediabetes, metabool syndroom of diabetes type 2.
Inhoud
-
Bloedsuikerregulering: insuline en glucagon
-
Wat is Time-in-Range?
-
Waarom HbA1c en nuchtere glucose niet het hele verhaal vertellen
-
IFG en IGT: vroege tekenen van disbalans
-
HbA1c: een waardevol maar gemiddeld beeld
-
Glucosemonitoring 2.0: continu inzicht in plaats van momentopnames
-
Postprandiale pieken: het onderbelichte risico
-
Time-in-Range demonstratie
-
Van pieken naar balans: hoe witte moerbeiblad kan helpen
-
Bronnen
Bloedsuikerregulering: insuline en glucagon
Glucose is de belangrijkste energiebron in ons lichaam. Vrijwel al onze cellen gebruiken het om energie (ATP) aan te maken. We halen glucose uit voeding, waarna het lichaam via een verfijnd systeem zorgt dat de bloedsuikerspiegel binnen gezonde grenzen blijft – met name via de lever.
Twee hormonen spelen hierin een sleutelrol: insuline, dat door de pancreas wordt geproduceerd en de opname van glucose in cellen stimuleert, en glucagon, dat juist het tegenovergestelde doet en glucose vrijmaakt uit de lever. Samen houden ze de bloedsuikerspiegel in balans, met invloed op de lever, spieren en vetcellen (1).
Waarom HbA1c en nuchtere glucose niet het hele verhaal vertellen
Het monitoren van de bloedsuikerspiegel is essentieel voor het tijdig herkennen van verstoringen in de glucosehuishouding. De meest gebruikte traditionele methoden zijn bloedtesten zoals de nuchtere glucosemeting, de orale glucosetolerantietest (OGTT) en de meting van het geglycosyleerde hemoglobine (HbA1c).(1) Hoewel deze testen waardevolle informatie opleveren, laten ze slechts een deel van het verhaal zien.
IFG en IGT: vroege tekenen van disbalans
Bij een verhoogde nuchtere glucosewaarde is er sprake van impaired fasting glucose (IFG), wat duidt op een beginnende verstoring in de glucoseregulatie. Ook de glucoserespons na het eten – gemeten via de OGTT – kan afwijkingen tonen. Als de glucosewaarden twee uur na inname van een glucose-oplossing boven de 7,8 mmol/L liggen, spreken we van impaired glucose tolerance (IGT). Zowel IFG als IGT worden beschouwd als prediabetische toestanden die een verhoogd risico geven op de ontwikkeling van diabetes type 2 (1,2).
HbA1c: een waardevol maar gemiddeld beeld
De HbA1c-waarde geeft een schatting van de gemiddelde bloedglucose over de afgelopen 2 à 3 maanden. Dit gebeurt via het meten van de hoeveelheid glucose die zich onomkeerbaar bindt aan hemoglobine in de rode bloedcellen. Omdat deze cellen ongeveer 10–12 weken leven, biedt HbA1c een betrouwbaar langetermijngemiddelde (1). Het is dan ook de standaard in diagnostiek en opvolging. Maar: het zegt niets over glucoseschommelingen, pieken of dalen. Precies daar komt een maat als Time-in-Range in beeld – voor wie verder wil kijken dan gemiddelden alleen.
Postprandiale pieken: het onderbelichte risico
De grootste schommelingen in de bloedsuikerspiegel treden op na de maaltijd en staan bekend als postprandiale glucosepieken (PPG). Juist deze pieken verdienen extra aandacht. Uit meerdere grootschalige studies en systematische reviews blijkt dat niet de nuchtere glucosewaarden, maar vooral de PPG-excursies het sterkst verband houden met het risico op cardiovasculaire aandoeningen, beroertes, atherosclerose, retinopathie, nierziekten en neuropathieën (4,5). Veel mensen - ook in de zorg - gaan ervan uit dat deze risico’s uitsluitend relevant zijn voor mensen met diabetes. In werkelijkheid nemen de risico’s al significant toe zodra de bloedglucosewaarden buiten het normale bereik vallen, ook bij ogenschijnlijk gezonde personen.
Time-in-Range demonstratie
Time-in-Range (TIR) biedt dus een waardevol perspectief dat ontbreekt bij traditionele metingen zoals HbA1c. Een praktijkvoorbeeld maakt dit duidelijk: drie personen kunnen exact dezelfde HbA1c-waarde hebben, maar een totaal verschillend patroon van glucosefluctuaties. De ene heeft stabiele waarden, de andere kampt met forse pieken en dalen. TIR laat zien wie daadwerkelijk metabool in balans is - en wie risico loopt, ondanks een ‘goede’ gemiddelde waarde.

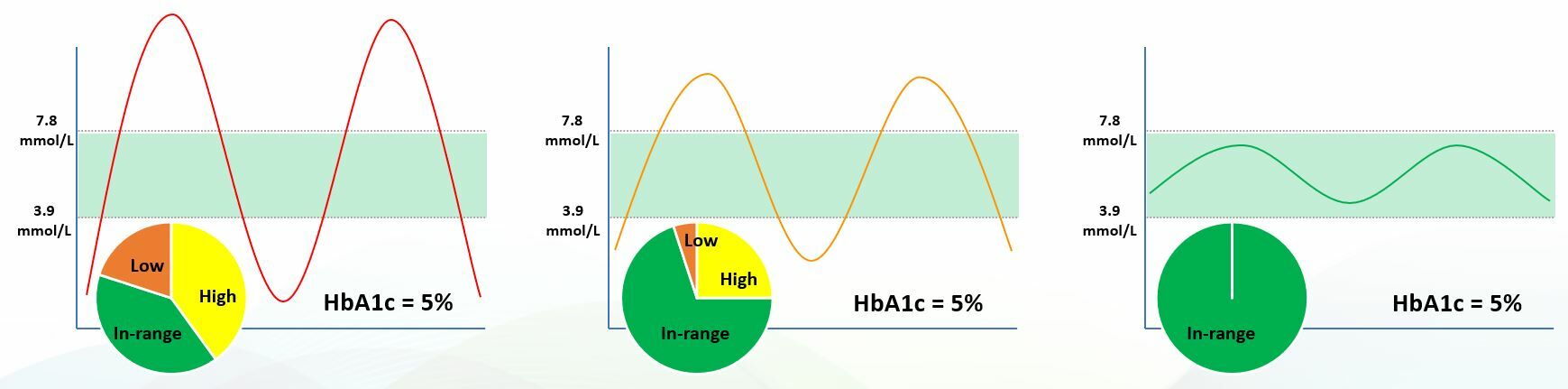
Van pieken naar balans: hoe witte moerbeiblad kan helpen
De verschillen in Time-in-Range worden goed zichtbaar in bovenstaande visuele vergelijking.
• Persoon 1 heeft slecht gecontroleerde glucosewaarden, met forse pieken en dalen, en brengt meer tijd buiten het gezonde bereik door dan erin.
• Persoon 2 voldoet aan de huidige richtlijnen, maar zit alsnog 30% van de dag boven of onder de optimale waarde - wat het risico verhoogt op oxidatieve schade aan kwetsbare weefsels, zoals bloedvaten, ogen en nieren.
• Persoon 3 daarentegen heeft een strak gereguleerde bloedsuikerspiegel en blijft continu binnen een gezond bereik.
Die derde situatie is waar we idealiter naar streven. Diverse plantstoffen hebben een gunstig effect op de bloedsuikerregulering. Zo kan een hoogwaardig extract van witte moerbeibladeren ondersteunen. De werkzame stof 1-deoxynojirimycine (DNJ) helpt om de snelle pieken na de maaltijd af te vlakken en voorkomt scherpe dalingen. Zo draagt witte moerbeiblad bij aan een stabieler glucoseprofiel gedurende de dag.
Bronnen:
1. McMillin JM. Blood Glucose. In: Walker HK, Hall WD, Hurst JW. Clinical Methods: The History, Physical, and Laboratory Examinations. 3rd edition. Boston: Butterworths; 1990. Chapter 141.
2. Nathan et al. Impaired fasting glucose and impaired glucose tolerance: implications for care. Diabetes Care, 2007; 30 (3).
3. Gabbay et al. Time in range: a new parameter to evaluate blood glucose control in patients with diabetes. Diabetes & Metabolic Syndrome, 2020; 12:22.
4. Wang et al. Clinical Update: Cardiovascular Disease in Diabetes Mellitus: Atherosclerotic Cardiovascular Disease and Heart Failure in Type 2 Diabetes Mellitus – Mechanisms, Management, and Clinical Considerations. Circulation, 2016; 133: 2459-2502
5. Shiraiwa et al. Postprandial hyperglycemia is a better predictor of the progression of diabetic retinopathy than HbA1c in Japanese type 2 diabetic patients. Diabetes Care, 2005; 28: 2806-2807